初三化学关于推断题的必备知识有哪些啊具体说说这些,化学常识题

1、初3化学关于推断题的必备知识有哪些啊具体说说这些
初3化学推断题解题技巧 推断题解题技巧 推断题是中考化学试题中常见的题型.该类题目考查知识面广、变化多端、思维容量大、综合性强,是考查学生求异思维、发散思维、抽象思维及逻辑推理能力的1类好题.但学生普遍感觉这类题难度较大,解题时不知从何下手,下面简述这类题的解题技巧.
1、解题的1般思路
2、推断题的常见突破口 1.物质特征 ⑴ 固体颜色:Fe、C、CuO、MnO
2、Fe3O4(黑色);Cu、Fe2O3(红色);Cu2(OH)2CO3(绿色);CuSO4??5H2O(蓝色)、S﹙黄色﹚. ⑵ 溶液颜色:含有Cu2+(蓝色);含有Fe2+(浅绿色);含有Fe3+(黄色). ⑶常见固体单质有Fe、Cu、C、S;气体单质有H
2、N
2、O2;无色气体有H
2、N
2、O
2、CO、CO
2、CH
4、SO2;常温下呈液态的物质有H2O. 2.现象特征 ⑴ 火焰颜色:S在O2中燃烧(蓝紫色);S、H2在空气中燃烧(淡蓝色);CO、CH4在空气中燃烧(蓝色). ⑵沉淀颜色:BaSO
4、AgCl、CaCO
3、BaCO3(白色);Cu(OH)2(蓝色);Fe(OH)3(红褐色). ⑶ 能使燃烧着的木条正常燃烧的气体是空气,燃烧得更旺的气体是O2,熄灭的气体是CO2或N2;能使带火星的木条复燃的气体是O2. ⑷ 能使白色无水CuSO4粉末变蓝的气体是水蒸气. 3.反应特征 ⑴ 能使澄清石灰水变浑浊的无色无味气体是CO2. ⑵ 能使黑色CuO变红(或红色Fe2O3变黑)的气体是H2或CO,固体是C. ⑶ 在O2中燃烧火星4射的物质是Fe. ⑷ 在空气中燃烧生成CO2和H2O的物质是有机物,如CH
4、C2H5OH等. ⑸ 能溶于盐酸或稀HNO3的白色沉淀有CaCO
3、BaCO3;不溶于稀HNO3的白色沉淀有AgCl、BaSO4.
3、推断题解题的常用方法 1.1点击破 顺藤摸瓜 有些推断题,涉及曲折迂回的转化历程,同学们总觉得无从下手,只要抓住题目的明显条件﹙即“突破口”﹚得出直接结论.常用顺推的方法,沿正向思路分析推理,顺藤摸瓜逐步得出结论. 2. 逆向思维 反向推断 有些推断题,利用题给条件﹙即“果”﹚探求未知﹙即“因”﹚.同学们可以运用物质相互反应规律由因究果的思维方法进行逆向推理,得出结论. 3.提出假设 逐1论证 有些推断题,可以根据题给条件,提出假设,然后归纳推敲筛选,得出合理的假设范围,最后验证得出的结论. 4.发散思维各个击破 有些推断题,可以根据各部分的已知条件,分别得出相应的结论,各个击破,然后综合推断,得出相应结论. 希望能解决您的问题.。

2、化学常识题
液态水中,还存在着少量的结晶水颗粒,约占0.01%。水升温时,发生两种变化:1是这些颗粒逐渐熔化成液态水;同时,由于分子间间隙增大,水的体积膨胀。 在0--4℃时,主要是前1种变化在影响着水的密度:冰熔化成水,使水的体积减小,因而密度变大; 在4℃以上时,主要是后1种变化占优势:水的体积膨胀,因此密度减小。 综上所述,在4℃时水的密度最大,而不是在0℃。
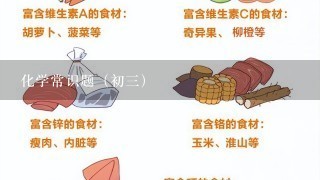
3、化学常识题(初3)
1.会腐蚀下水道2.CuSO4+Fe==FeSO4+Cu3.FeAl + Fe3+ == Al3+ + Fe铝可以把铁从其溶液中置换出来最后1个是铁(你的水壶是铝的,在水中置换出来的东西是铁的)铁和银的粉末没有金属光泽,是黑色的。

4、做 高中化学离子推断题 需要掌握的或常用的基本知识点有哪些??
1,物质颜色 红色:Fe2O3,Fe(OH)3,FeSCN2+,Cu2O,Cu,NO2,Br2(g),P; 橙色:Br2的溶液; 黄色:S,Na2O2,AgBr,AgI,Ag3PO4,Fe3+(aq),久置浓HNO3; 绿色:Fe2+(aq),绿矾,铜绿,浓CuCl2,Cu+浓HNO3; 蓝色:Cu2+(aq),胆矾,Cu(OH)2; 紫色:石蕊,KMnO4,I2(g),Fe3++C6H5OH; 黑色:多数过渡金属的氧化物以及硫化物,C,Fe等; 白色:CaCO3,BaSO4,AgCl,Mg(OH)2,Al(OH)3,MgO,Al2O3. 2,物质状态 液态单质:Br2,Hg; 液态化合物:H2O,H2O2,H2SO4,HNO3等; 气态单质:H2,N2,O2,F2,Cl2等; 气态化合物:C,N,S的氢化物及氧化物等. 3,反应现象或化学性质 (1)焰色反应:黄色—Na;紫色(钴玻璃)—K. (2)与燃烧有关的现象: 火焰颜色:苍白色:H2在Cl2中燃烧; (淡)蓝色:H2,CH4,CO 等在空气中燃烧; 黄色:Na在Cl2或空气中燃烧; 烟,雾现象: 棕(黄)色的烟:Cu或Fe在Cl2中燃烧; 白烟:Na在Cl2或P在空气中燃烧; 白雾:有HX等极易溶于水的气体产生; 白色烟雾:P在Cl2中燃烧. (3)沉淀特殊的颜色变化: 白色沉淀变灰绿色再变红褐色:Fe(OH)2→Fe(OH)3; 白色沉淀迅速变棕褐色:AgOH→Ag2O. (4)使湿润的红色石蕊试纸变蓝的气体:NH3; (5)能使品红溶液褪色加热后又复原的气体:SO2; (6)在空气中迅速由无色变成红棕色的气体:NO; (7)使淀粉溶液变蓝的物质:I2; (8)能漂白有色物质的淡黄色固体:Na2O2; (9)在空气中能自燃的固体:P4; (10)遇SCN-变红色,OH-产生红褐色沉淀,苯酚显紫色的离子:Fe3+; (11)不溶于强酸和强碱的白色沉淀:AgCl,BaSO4; (12)遇Ag+生成不溶于硝酸的白色,浅黄色,黄色沉淀的离子分别是:Cl-,Br-,I-. (13)可溶于NaOH的白色沉淀:Al(OH)3,H2SiO3;金属氧化物:Al2O3; (14)可溶于HF的酸性氧化物:SiO2; (15)能与NaOH溶液反应产生气体的单质:Al,Si,;化合物:铵盐; (16)能与浓硫酸,铜片共热产生红棕色气体的是:硝酸盐; (17)通入2氧化碳产生白色胶状沉淀且不溶于任何强酸的离子:SiO32-; (18)溶液中加酸产生的气体可能是:CO2,SO2,H2S; 溶液中存在的离子可能是:CO32-,HCO3-;SO32-,HSO3-;S2-,HS-; (19)同1元素的气态氢化物和最高价氧化物对应水化物能反应生成盐的元素:N; (20)与酸,碱都能反应的无机物:Al,Al2O3,Al(OH)3,弱酸酸式盐,弱酸弱碱盐等; (21)能与水反应生成气体的物质:K,Na,NaH;Na2O2,CaC2及Mg3N2,Al2S3等; (22)既有气体又有沉淀生成的反应:Ba(OH)2,Ca(OH)2与NH4HCO3,(NH4)2SO4等; (23)先沉淀后溶解的反应:Ca(OH)2+CO2,AgNO3+氨水,Al3++OH-,AlO2-+OH-,Ba(OH)2+H3PO4 等; (24)见光易分解的物质:HClO,HNO3,AgCl,AgBr,AgI; (25)使用催化剂的反应:合成氨,3氧化硫的生成,氨的催化氧化,制氧气等. 4,特殊的反应类型: 往往是题目的隐性突破口. (1)单质A + 化合物B → 单质C + 化合物D 即置换反应,可以是金属置换出金属(最常见的是铝热反应)或金属置换出非金属(被置换出来的非金属应该是还原产物,而还原产物在1定条件下具有1定的还原性,故通常是H2或C),也可以是非金属置换出非金属(常见的是卤素单质之间的置换或F2置换出O2,当然卤素都能置换出S,另外C可以置换出Si,H2)或非金属置换出金属(此时的非金属必作还原剂,而常见的还原性非金属只有C和H2). (2)A 的化合物 + A的化合物 → A 的单质 + 化合物B 该反应通常是1个归中到单质的反应,该单质必为非金属单质,常见的是S,Cl2,N2. (3)单质A + 强碱 →两种含A 元素的化合物 该反应是1个碱性歧化反应,单质A 通常是X2或S; (4)单质A + 单质B → 化合物C ;C + 单质A → 化合物D 综合以上两个反应,可知A,B两种元素可以形成C,D两种以上的化合物,其中必定有1种元素有变价.若有变价的元素是金属,则必为Fe;若有变价的元素为非金属则该元素通常是C,N,S或O等,故以上C,D分别是NO,NO2或CO,CO2,或SO2,SO3或Na2O,Na2O2等. (5)1种物质分解得到两种以上产物: 常见的有KMnO4,NaHCO3,NH4HCO3,(NH4)2CO3,NH4I,Cu2(OH)2CO3等的分解. (6)多种物质化合得到1种物质: 如Fe(OH)2+O2+H2O;NOx+O2+H2O等 (7)电解类型(惰性电极): 生成两种产物:电解质分解型或电解水型或熔融的NaCl等. 生成3种产物:放氧生酸型或放氢生碱型. 生成3种气体:电解氨水或NH4Cl溶液. (8)与化工生产有关的反应: 如制漂白粉,制生石灰,工业合成氨,氯碱工业,硫酸工业,硝酸工业,玻璃工业等.。

5、高1化学,这道题都有哪些知识点,比如说钠—羟基
这道题涉及到醇(或是说伯醇)的化学性质: 醇的酸性(活泼羟基氢);醇的亲核取代(分子间脱水成醚);醇的消去(β-H消去,生成烯烃)。

6、简单化学常识题
题呢?Na2SO4因为:2SO2+O2+4NaOH=2Na2SO4+2H2O。




















































